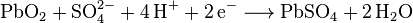Ok ...Anton B. hat geschrieben:Ja. Schwefelsäure wird aber auch den starken Elektrolyten zugeordnet. Die elektrische Leitfähigkeit der Schwefelsäure ist aber sehr viel besser als die einer gleichmolaren Kochsalzlösung,clausadi hat geschrieben:Ok, Kochsalz aber hat wohl ein noch besseres Dissoziationsvermögen, weshalb gemäß Wiki Kochsalz ein starker Elektrolyt ist, oder nicht?Anton B. hat geschrieben:Der Text spricht doch nur von Essigsäure als Beispiel für einen schwachen Elektrolyten. Der Text differenziert "Stoffe" aufgrund ihres Dissoziationsvermögens. Und das ist bei Schwefel- und Salzsäure im Gegensatz zur Essigsäure ganz ausgeprägt.
Also beim elektrostatischen Aufladen eines Blei-Akkus mittelst Gleichstroms entsteht Knallgas (Wasserstoff-Sauerstoff-Gemisch), welches aus dem Elektrolyt ausgast.Anton B. hat geschrieben:weil
- Neben den Dissoziationsresten noch -- Pluto sagte es schon -- Wasserstoffionen produziert werden
- Und -- Pluto sagte es schon -- die Leitfähigkeit mithilfe der Wasserstoffionen größer ist als einer gleichmolaren Na+-Lösung. Weil nämlich die Wasserstoffionen in der wässrigen Lösung viel mobiler sind.
Folglich können Wasserstoff und Sauerstoff an der elektrischen Leitfähigkeit des Elektrolyten nicht beteiligt sein.
So ist es, denn die grundlegende Physik einer Batterie bzw. Akkumulator ist Elektrizität, also die elektrostatische Aufladung von Materie.Anton B. hat geschrieben:Genau. Und dass die Funktionsweise des Akkumulators nicht auf chemischen Reaktionen beruhen, sondern ein elektrostatisches Phänomen darstelle.clausadi hat geschrieben:Also meine Aussage war, dass der Elektrolyt in einem Blei-Säure-Akku den elektrischen Kreis schließt. Denn ein elektrischer Kreis muss geschlossen sein, damit ein elektrischer Strom fließen kann.
Denn Materie speichert elektrische Energie (Elektrizität).
Denn ein Akkumulator speichert elektrische Energie (Elektrizität), ist aber im Gegensatz zur Batterie wieder elektrostatisch aufladbar.
Denn ein Akkumulator muss zuvor mittelst Gleichstroms elektrostatisch aufgeladen werden, damit der Akku elektrische Energie (Elektrizität) abgeben kann.
Folglich gewinnt ein Akku die elektrische Energie nicht aus einer chemischen Reaktion!
Mit Kochsalzlösung funktioniert es gar nicht???Anton B. hat geschrieben:Weil es mit einer Kochsalzlösung aufgrund des chemischen Erklärungsmodells nicht funktionieren würde.clausadi hat geschrieben:Ok, und weshalb verwendet man bei einem Blei-Akku Schwefelsäure und nicht Kochsalz als Elektrolyt?
Oben aber hast du gesagt, Kochsalzlösung hätte lediglich eine andere elektrische Leitfähigkeit als wässerige Schwefelsäure Lösung.
Wie gesagt, die grundlegende Physik einer Batterie bzw. Akkumulator ist Elektrizität, also die elektrostatische Aufladung von Materie.Anton B. hat geschrieben:Wenn es genausogut -- aufgrund der clausadi'schen Elektrostatiktheorie auch funktioniert,clausadi hat geschrieben:Also ein Blei-Säure-Akku besteht aus zwei Blei-Elektroden und Schwefelsäure in wässeriger Lösung als Elektrolyt. Was sich sich bisher bestens bewährt hat.
- könnten die Batterien und Akkumulatoren sehr viel günstiger, umweltfreundlicher usw. hergestellt werden
- wäre die Theorie der elektrochemischen Begründung der Funktionsweise von Batterien und Akkumulatoren falsifiziert und die Lehrbücher und "Tante wiki" könnten korrigiert werden.
Denn Materie speichert elektrische Energie (Elektrizität).
Denn ein Akkumulator speichert elektrische Energie (Elektrizität), ist aber im Gegensatz zur Batterie wieder elektrostatisch aufladbar.
Denn ein Akkumulator muss zuvor mittelst Gleichstroms elektrostatisch aufgeladen werden, damit der Akku elektrische Energie (Elektrizität) abgeben kann.
Folglich gewinnt ein Akku die elektrische Energie nicht aus einer chemischen Reaktion!